Mabion z pozytywną opinią
- Utworzono: poniedziałek, 02, marzec 2015 12:48

Spółka Mabion pod koniec lutego przedstawiła ponownie Komisji Data and Safety Monitoring Board,wyniki badań klinicznych nad nowym lekiem MabionCD20. Również tym razem opinia członków komisji była pozytywna.
Posiedzenia komisji DSMB odbywają się regularnie podczas całego procesu badania klinicznego. Członkowie komisji mają możliwość m.in. udzielania porad naukowych związanych z badaniem oraz sugerowania zmian w protokole badania klinicznego. Komisja DSMB – podobnie jak podczas trzech poprzednich posiedzeń – pozytywnie oceniła badanie leku MabionCD20. Preparat MabionCD20 jest dobrze tolerowany zarówno po pierwszym, jak i po kolejnych podaniach. Nie zaobserwowano różnic w profilu bezpieczeństwa MabionCD20 w stosunku do leku referencyjnego MabThera wśród analizowanej grupy pacjentów.
„To już czwarte zebranie ekspertów, podczas którego ocenione były dane kliniczne pod kątem bezpieczeństwa terapii. Do dnia 27 lutego zrekrutowaliśmy 109% niezbędnych pacjentów do badania głównego, z czego 75% pacjentów to grupa, która otrzymała wszystkie przewidziane protokołem badania podania leku. Wartości przekraczające 100% wynikają z faktu, iż standardową procedurą w badaniach klinicznych jest włączanie dodatkowej grupy pacjentów, której zadaniem jest zbilansowanie utraty tych pacjentów, którzy rozpoczęli udział w badaniu, ale potencjalnie mogą go nie ukończyć (np. poprzez złamanie protokołu przez ośrodek badawczy i konieczność wykluczenia części danych klinicznych).
Według wystawionej opinii procedury badania klinicznego MabionCD20 nie wymagają żadnych modyfikacji. Rekrutacja pacjentów przebiega płynnie i zgodnie z oczekiwaniami, a uzyskana opinia DSMB pozwala na finalizację badań klinicznych zgodnie z przygotowanym protokołem. Aktualnie badanie kliniczne jest aktywne na terenie Polski, Ukrainy, Gruzji, Bośni Hercegowiny oraz Serbii. W związku z zaawansowanym stopniem badania jego zakres terytorialny jest i będzie systematycznie ograniczany. Brak różnic w profilu bezpieczeństwa MabionCD20 do leku referencyjnego MabThera w tak precyzyjnie zaplanowanym badaniu jest dobrym prognostykiem do wprowadzenia leku na arenie międzynarodowej” – mówi Maciej Wieczorek, prezes zarządu Mabion SA.
Mabion SA jest już w ostatniej fazie badań klinicznych związanych z lekiem MabionCD20. Wśród kluczowych założeń spółki, jakie udało się do tej pory zrealizować znajdują się:
- Zaawansowany stopień badań klinicznych w podstawowym badaniu na reumatoidalne zapalenie stawów (RZS), przeprowadzanym na ok. 700 pacjentach oraz badaniu uzupełniającym przeprowadzanym na ok. 140 pacjentach z chłoniakiem rozlanym. Ich zakończenie pozwoli na przygotowanie dokumentacji jakościowej i badawczej, stanowiącej istotną część dossier rejestracyjnego leku. Dokumentacja zostanie przedłożona w Europejskiej Agencji Leków (EMA) w procesie zatwierdzania MabionCD20 do obrotu.Przeprowadzone pomyślnie badania umożliwią rejestrację i dystrybucję MabionCD20 na terenie Europy.
- Zaawansowany etap realizacji Kompleksu Naukowo-Przemysłowego Biotechnologii Medycznej (zakładu dużej skali), którego pozwolenie na użytkowanie oraz certyfikacja przez Główny Inspektorat Farmaceutyczny planowana jest jeszcze w pierwszym półroczu 2015 r. Dzięki zwiększeniu skali produkcji przeciwciał monoklonalnych z 2x250 do 2x2500 litrów, możliwe będzie szybsze wyprodukowane, a tym samym szybsze podanie leku pacjentom biorącym udział w badaniu. Pierwszym lekiem, którzy będzie produkowany na terenie zakładu dużej skali w Konstantynowie Łódzkim będzie MabionCD20, który obecnie znajduje się na zaawansowanym etapie badań klinicznych. Wytwarzanie leku MabionCD20 do badań klinicznych już na terenie nowej inwestycji spółki ułatwi rejestrację leku od razu na nowy, docelowy zakład wytwarzania.Nowy zakład na bieżąco dostosowywany jest także do wymogów Amerykańskiej Agencji Żywności i Leków (FDA). Dostosowanie Kompleksu Naukowo-Przemysłowego do wymogów FDA już na etapie badań i wyposażenia znacznie obniży koszty certyfikacji oraz usprawni cały proces.Zakończenie prac i certyfikacja Zakładu w Konstantynowie Łódzkim pozwoli na przeniesienie produkcji leku MabionCD20 i tym samym uwolni moce produkcyjne Centrum Badawczo-Rozwojowego w Łodzi do prac nad preparatem MabionHER2.
- Kontynuacja działań mająca na celu rejestrację leku MabionCD20 mniej ściśle regulowanych, gdzie dystrybucja będzie odbywała się za pośrednictwem lokalnych partnerów. Są to przede wszystkim regiony Ameryki Środkowej i Południowej, Afryki Północnej, Bliskiego Wschodu oraz Krajów bałkańskich. W ostatnich miesiącach spółka wspólne z LKM SA wystąpiła w Argentynie z wnioskiem o zgodę na rozpoczęcie procedury rejestracyjnej leku MabionCD20, wykorzystywanego w terapii nowotworów krwi i reumatoidalnego zapalenia stawów (RZS). Komplet dokumentacji badawczej i prawnej został złożony w argentyńskim Ministerstwie Zdrowia – centralnej jednostce ewidencjonującej badania kliniczne w tym kraju.
Badania kliniczne zostały zaprojektowane i są prowadzone zgodnie z wytycznymi Europejskiej Agencji ds. Leków, a także zgodnie z zasadami Dobrej Praktyki Klinicznej (GCP), natomiast ocena laboratoryjna i biochemiczna wykonana zostanie w standardzie Dobrej Praktyki Laboratoryjnej (GLP).Wybrane kryteria włączania pacjentów do badania okazały się bardzo korzystne dla tempa ich rekrutacji oraz ich bezpieczeństwa w badaniu. Ponadto jednym z celów spółki jest wprowadzenie leków na rynek amerykański. W związku z tym w listopadzie 2012 roku Mabion zakończył pozytywnie wspólną procedurę Scientific Advice w Europejskiej Agencji ds. Leków (EMA) i Amerykańskiej Agencji ds. Żywności (FDA) w zakresie rozwoju jakościowego oraz klinicznego leku MabionCD20. Potwierdziło tomożliwość rozpoczęcia przygotowywania planów regulacyjnych i marketingowych na rynku Stanów Zjednoczonych. Dodatkowo Mabion SA podpisał list intencyjny z Regulatory Compiliance Associates, które dostarcza całościowe rozwiązania dotyczące regulacji oraz zgodności z wymogami FDA. Wśród kadry RCA znajdują się osoby, które w swojej karierze zawodowej były audytorami FDA. Podpisany list intencyjny obejmuje m.in. wykrycie potencjalnych ryzyk przy certyfikacji oraz zaproponowanie sposobów na ich zminimalizowanie w celu maksymalizacji prawdopodobieństwa uruchomienia produkcji w Kompleksie Naukowo-Przemysłowym Biotechnologii Medycznej w Konstantynowie Łódzkim w założonym terminie.
Mabion zamierza zarejestrować MabionCD20 na wszystkich rynkach światowychna których sprzedawane są leki referencyjne. Geograficznie można podzielić je na 3 główne regiony: Stany Zjednoczone, kraje Unii Europejskiej i pozostałe kraje świata, gdzie rejestracja jest mniej ściśle uregulowana. W przypadku regionów o mniej ściśle uregulowanym systemie rejestracji – jak na przykład Afryka czy Azja – zarówno realizację sprzedaży, jak i całą procedurę rejestracji Mabion planuje przeprowadzić za pośrednictwem lokalnych, wiodących firm farmaceutycznych. Produkcja będzie realizowana w zakładach Mabion w Polsce, a Spółka będzie miała udział w przychodach ze sprzedaży leków przez zagranicznych dystrybutorów. Dotychczas Mabion podpisał:
- umowę z islandzką firmą farmaceutyczną LYFIS w odniesieniu do terytorium Islandii
- umowę z ukraińską firmą farmaceutyczną Farmak w odniesieniu do Ukrainy, Armenii, Azerbejdżanu, Białorusi, Gruzji, Kazachstanu, Kirgistanu, Mołdawii, Tadżykistanu, Turkmenistanu i Uzbekistanu
- umowę z turecką firmą farmaceutyczną ONKO w odniesieniu do Turcji
- umowę z kostarykańską firmą farmaceutyczną w odniesieniu do krajów Ameryki Środkowej (Kostaryki, Hondurasu, Nikaragui, Belize, Dominikany, Salwadoru, Trinidadu i Tobago oraz Panamy)
- umowę z marokańską firmą farmaceutyczną Sothema Laboratories w odniesieniu do krajów Afryki Północnej (Maroka, Algierii i Tunezji)
- umowę z argentyńską firmą farmaceutyczną LKM SA w odniesieniu do krajów Ameryki Południowej (Argentyny, Kolumbii, Wenezueli, Peru, Chile, Paragwaju, Ekwadoru, Boliwii i Urugwaju)
- list intencyjny z firmą farmaceutyczną z Libanu w odniesieniu do krajów Bliskiego Wschodu
- list intencyjny z firmą farmaceutyczną z Chorwacji w odniesieniu do krajów bałkańskich
-
Popularne
-
Ostatnio dodane
Menu
O Finweb
ANALIZY TECHNICZNE
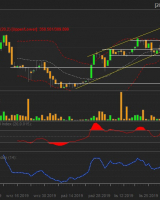
Grupa Kęty S.A. - ...
Trend na wykresie Grupy Kęty jest wzrostowy. ...
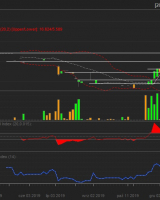
Kredyt Inkaso S.A. - ...
Pod koniec roku 2017, a w każdym razie w ...
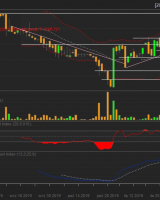
Torpol S.A. - analiza ...
Na przełomie sierpnia i września wykres Torpolu ...
Odwiedza nas
Odwiedza nas 4102 gości






















